INTRODUCCIÓN
Los líquidos tienen propiedades físicas características como: densidad, ebullición, congelación y evaporación, viscosidad, capacidad de conducir corriente, etc. Para estas propiedades cada líquido presenta valores característicos constantes.
Muchas de las propiedades importantes de las disoluciones dependen del número de partículas de soluto en la solución y no de la naturaleza de las partículas del soluto. Estas propiedades se denominan propiedades coligativas porque tienen un mismo origen; esto es, todas ellas dependen del número de partículas sean átomos, moléculas o iones.
Propiedades de las soluciones
|
Propiedades constitutivas: aquellas que dependan de la naturaleza de las partículas disueltas. Ejemplo: viscosidad, densidad, conductividad eléctrica, etc.
|
|
|
Propiedades coligativas: dependen del número de partículas disueltas en una cantidad fija de disolvente y no de la naturaleza de estas partículas. Ej. Descenso de la presión de vapor, aumento del punto de ebullición, disminución del punto de congelación, presión osmótica.
|
Las propiedades coligativas no guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos.
Son función sólo del número de partículas y son resultado del mismo fenómeno: el efecto de las partículas de soluto sobre la presión de vapor del disolvente.
Utilidades de las propiedades coligativas:
a. separar los componentes de una solución por destilación fraccionada
b. formular y crear mezclas frigoríficas y anticongelantes
c. determinar masas molares de solutos desconocidos
d. formular sueros fisiológicos para animales
e. formular caldos de cultivos para microorganismos
f. formular soluciones de nutrientes especiales para regadíos de vegetales
PRESIÓN DE VAPOR
Evaporación es la tendencia de las partículas de la superficie del líquido, a salir de la fase liquida en forma de vapor. Es importante saber que no todas las partículas de liquido tienen la misma energía cinética (no todas se mueven a la misma velocidad). Las partículas con mayor energía en la superficie pueden escaparse a la fase gaseosa. Las moléculas de la fase gaseosa que chocan contra la fase liquida ejercen una fuerza contra la superficie del líquido, a la que se le denomina presión de vapor, cuando ambas fases están en equilibrio dinámico. Esta presión de vapor depende de la temperatura y de la naturaleza del líquido.
Para un mismo líquido, la presión de vapor aumenta a medida que aumenta la temperatura. Líquidos diferentes a la misma temperatura presentan presiones de vapor diferentes.
DISMINUCION DE LA PRESIÓN DE VAPOR
Si un soluto es no volátil la presión de vapor de su disolución es menor que la del disolvente puro. Así que la relación entre la presión de vapor y presión de vapor del disolvente depende de la concentración del soluto en la disolución. Cuanto más soluto añadimos, menor es la presión de vapor observada. La formulación matemática de este hecho viene expresada por la observación de Raoult de que el descenso relativo de la presión de vapor del disolvente en una disolución es proporcional a la fracción molar del soluto.
Las diferencias entre las presiones de vapor se cuantifican según las siguientes relaciones:
P1 = X1P°1
P1 = (1 – X2) P°1
P°1 – P1 = ΔP = X2 P°1
Ejemplo. Consideremos una disolución formada por 1 mol de benceno y 2 moles de tolueno. El benceno presenta una presión de vapor P0 de 75 mmmHg y el Tolueno de 22mmHg a 20°C. ¿Cuál es la Presión total?
Respuesta: La fracción molar de benceno y Tolueno serán:
X benceno = 1 / 1+2 = 0,33 X Tolueno = 2 /1+2 = 0,67
Las presiones parciales serán:
P benceno = 0,33 x 75mmHg = 25 mmHg ; P Tolueno = 0,67 x 22 mmHg = 15 mmHg
y la PT será: PT = 25 mmHg + 15 mmHg = 40 mmHg.
ELEVACION DEL PUNTO DE EBULLICIÓN
El punto de ebullición de una sustancia es la temperatura a la cual su presión de vapor iguala a la presión atmosférica externa.
¿Cómo difieren los puntos de ebullición y de congelación de una solución hídrica de los del agua pura? La adición de un soluto no volátil disminuye la presión de vapor de la solución. Como se puede ver en una curva de presión de vapor de una solución. Cambiará hacia abajo relativo a la curva de presión de vapor del agua líquida pura; a cualquier temperatura dada, la presión de vapor de la solución es más baja que la del agua pura líquida. Teniendo en cuenta que el punto de ebullición de un líquido es la temperatura a la cual su presión de vapor es igual a 1 atm., al punto de ebullición normal del agua líquida, la presión de vapor de la solución será menor de 1 atm. Por consiguiente se necesitará una temperatura más alta para alcanzar una presión de vapor de 1 atm. Así el punto de ebullición es mayor que el del agua líquida.
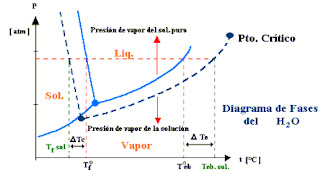
Para incrementar el punto de ebullición relativo al del solvente puro, T, es directamente proporcional al número de partículas del soluto por mol de moléculas de solvente. Dado que la molalidad expresa el número de moles de soluto por 1000 g de solvente, lo cual representa un número fijo de moles del solvente. Así T es proporcional a la molalidad.
ΔTb = Kb m
Kb = constante de elevación del punto de ebullición normal, solo depende del solvente. Para el agua es 0.52 °C / m, por consiguiente una solución acuosa 1 m de sacarosa o cualquier otra solución acuosa que sea 1 m de partículas de soluto no volátil ebullirá a una temperatura 0.52 °C más alta que el agua pura.
Ejemplo. ¿Cuál es el punto de ebullición de una solución de 100g de anticongelante etilenglicol C2H6O2 en 900 g de agua (Ke= 0,52°C/m)?
(datos: masa soluto 100g; peso molecular etilenglicol 62 g/mol; masa solvente agua 900g; peso molecular agua 18 g/mol; Ke = 0,52°C/m; T°e= 100°C)
Respuesta: Si dTe= Te - T°e (1) y dTe = Ke m (2), para obtener Te necesitamos dTe (ascenso de temperatura de ebullición), lo obtenemos de ecuación (2).
62g ----- 1 mol
100g ----X moles ; X = 1,613 moles de soluto
Molalidad = 1,613 moles/ 0,9 Kg solvente = 1,792 molal
Luego dTe = 0,52°C/m x 1,792 molal = 0,9319°C
Asi en la ecuación (1), dTe = 0,9319 = Te - T°e
0,9319 + 100 = Te
Te = 100,9319°C
REDUCCION EN EL PUNTO DE CONGELACIÓN
La presión de vapor más baja de una solución con relación al agua pura, también afecta el punto de congelamiento de la solución, esto se explica porque cuando una solución se congela, los cristales del solvente puro generalmente se separan; las moléculas de soluto normalmente no son solubles en la fase sólida del solvente. Por ejemplo cuando soluciones acuosas se congelan parcialmente, el sólido que se separa casí siempre es hielo puro, como resultado la parte del diagrama de fase en la figura anterior que representa la presión de vapor del sólido es la misma que para el agua líquida pura. En esta misma figura puede verse que el punto triple de la solución a una temperatura menor que el del agua pura líquida debido a que la presión de vapor más baja de la solución comparada con la del agua líquida pura.
El descenso del punto de congelación
dTc = T°cB - TAB
Siendo T°cB el punto de congelación del solvente puro y TAB el punto de congelación de la disolución.
Experimentalmente, también se observa que dTc = Kc m
donde Kc es la constante crioscópica que representa el descenso del punto de congelación de una solución 1 molal y es propia de cada disolvente y esta tabulada. Para el agua es 1,86°C/m; m es la molalidad.
Ejemplo. Para el etilenglicol se debe calcular el punto de congelación de una solución de 100g de anticongelante, en 900 g de agua, sabiendo que Kc= 1,86°C/molal
Respuesta: Determinemos la molalidad de la disolución:
62g ------ 1mol
100g -----X; X = 1,61 moles de soluto; molalidad = 1,61 moles/0,9 Kg solvente = 1,79 molal
Así dTc = 1,86°C/m x 1,79 molal = 3,33°C
despejando se obtendrá: 3,33°C = dTc = T°c - Tc ; si T°C = O°C, entonces: Tc = -3,33°C
PRESION OSMÓTICA Y OSMOSIS
Ciertos materiales, incluyendo muchas membranas de los sistemas biológicos y sustancias sintéticas como el celofán son semipermeables. Cuando se ponen en contacto con una solución, ellas permiten el paso de algunas moléculas pero no de otras. Generalmente permiten el paso de las moléculas pequeñas de solvente como el agua pero bloquean el paso de solutos más grandes o iones. El carácter semipermeable, se debe a la red de poros diminutos de la membrana.
La presión osmótica es la propiedad coligativa más importante por sus aplicaciones biológicas, pero antes de entrar de lleno en el estudio de esta propiedad es necesario revisar los conceptos de difusión y de ósmosis.
Difusión es el proceso mediante el cual las moléculas del soluto tienen a alcanzar una distribución homogénea en todo el espacio que les es accesible, lo que se alcanza al cabo de cierto tiempo.
En Biología es especialmente importante el fenómeno de difusión a través de membranas, ya que la presencia de las membranas biológicas condiciona el paso de disolvente y solutos en las estructuras celulares.
La presencia de una membrana separando dos medios diferentes impone ciertas restricciones al proceso de difusión de solutos, que dependerán fundamentalmente de la relación entre el diámetro de los poros de la membrana y el tamaño de las partículas disueltas. Las membranas se clasifican en cuatro grupos:
Impermeables: no son atravesadas ni por solutos ni por el disolvente
Semipermeables: no permiten el paso de solutos verdaderos, pero sí del agua
Dialíticas: son permeables al agua y solutos verdaderos, pero no a los solutos coloidales
Permeables: permiten el paso del disolvente y de solutos coloidales y verdaderos
Las leyes que regulan los valores de la presión osmótica para disoluciones muy diluidas (como las que se manejan en Biología) son análogas a las leyes de los gases. Se conocen con el nombre de su descubridor Jacobus H. Van t'Hoff, premio Nobel de Química en 1901, y se expresan mediante la siguiente fórmula:
π= m R T
donde π representa la presión osmótica, m es la molalidad de la disolución, R es la constante universal de los gases y T es la temperatura absoluta.
Y esta ecuación es derivada de la Ley general de los gases.
Ejemplo. La presión osmótica promedio de la sangre es 7,7 atm a 25°C. ¿Qué concentración de glucosa será isotónica con la sangre?
Respuesta: M = π/RT, reemplazando, M=7,7 atm /0,082L atm/°Kmol x 298°K
M = 0,31 M o 5,3%
Fuentes:
Castellan GW. (1998). Fisicoquímica. Segunda Edición. Pearson, Addison Wesley editores. México. 297-313.





